Pernahkah Anda melihat pohon asam jawa? Buah asam jawa tumbuh bergelantung dengan beberapa biji dalam setiap buahnya. Beberapa kandunga asam jawa berupa senyawa asam seperti asam sitrat, asam tartart, asam suksinat, asam malat dan asam asetat. Kandungan kimia asam jawa berkhasiat untuk mengobati asma, batuk, demam dan bengkak karena sengatan lipan atau lebah. Apakah yang dimaksud dengan senyawa asam? Temukan jawabannya pada uraian dibawah ini..
Konsep Asam-Basa
Istilah asam (acid) berasal dari bahasa latin acelum yang berarti cuka. Sebaliknya, senyawa yang memiliki sifat sangat berbeda dibanding asam yaitu senyawa alkali (basa) yang diturunkan dari abu berbagai tanaman, Suatu senyawa dapat diketahui bersifat asam atau basa jika berada dalam bentuk larutannya. Istilah asam digunakan untuk senyawa yang dalam bentuk larutannya menghasilkan ion hidrogen (H+). Sementara itu, basa digunakan untuk senyawa yang dalam bentuk larutannya terurai menjadi ion hidroksida (OH-).
Teori Arrhenius
Pada tahun 1886, Svante August Arrhenius, ilmuwan dari Swedia menyatakan teori tentang asam dan basa. Menurut Arrhenius, asam merupakan zat yang menghasilkan ion hidrogen (H+) apabila terlarut dalam air, sedangkan basa didefinisikan sebagai zat yang menghasilkan ion hidroksida (OH-) jika dilarutkan dalam air. Jadi, teori ini hanya terbatas pada pelarut air saja. Jika pelarutnya bukan air dan zat yang terurai tidak mengandung H+ dan OH-, teori ini tidak berlaku. Contoh reaksi yang tidak dapat dijelaskan dengan teori Arrhenius:
NH3(g) + HCIfg) NH4CI(s)
Reaksi tersebut tidak melibatkan adanya H+ dan OH-. Proses terurainya zat menjadi ion-ion disebut ionisasi.
Beberapa contoh ionisasi asam dan basa sebagai berikut.
Reaksi ionisasi pada beberapa asam:
HNO3 → H+ + NO3
H2SO4 → 2H+ + SO24-
H3PO4 → 3H+ + PO34-
H2C2O4 → 2H+ + C2O24-
Reaksi ionisasi pada beberapa basa:
KOH → K+ + OH-
Ca(OH)2 → Ca2+ + 20H-
Ba(OH)2 → Ba2+ + 20H-
Reaksi-reaksi yang tidak melibatkan H+ dan OH- dapat dijelaskan menggunakan teori Bronsted-Lowry dan teori Lewis.
Berdasarkan jumlah ion H+ (untuk asam) dan ion OH- (untuk basa) yang dihasilkan dalam reaksi ionisasi, senyawa asam-basa dapat dikelompokkan menjadi asam-basa monoprotik (jumlah ion H+/OH¬- > 1) dan asam-basa poliprotik (jumlah ion H+/OH¬- > 1) Asam-basa poliprotik dapat mengalami beberapa kali reaksi ionisasi. Perhatikan contoh berikut.
Contoh :
H3PO4(aq) 3H+(aq) + PO34-(aq)
Reaksi ionisasi 1 = H3PO4(aq) → H+(aq) + H2PO-(aq)
Reaksi ionisasi 2 = H2PO-4(aq) → H+(aq) + HPO24-(aq)
Reaksi ionisasi 3 = HPO24-(aq) → H+(aq) + PO34- (aq)
Teori Bronsted-Lowry
Pada tahun 1923, Johannes Nicolaus Bronsted, kimiawan dari Denmark dan Thomas Martin Lowry, kimiawan dari Amerika Serikat mendefinisikantentang asam-basa. Menurut Bronsted-Lowry, asam adalah spesi yang memberikan (donor) proton, sedangkan basa adalah spesi yang bertindak sebagai penerima (akseptor) proton dalam suatu reaksi transfer proton.
Teori Bronsted-Lowry melengkapi konsep asam-basa Arrhenius. Ion hidroksida dalam teori Arrhenius tetap menjadi basa dalam teori Bronsted- Lowry. Ion hidroksida (OH“) ini menerima ion hidrogen (H+) membentuk H20. Pada reaksi asam-basa Bronsted-Lowry terdapat dua pasangan asam-basa konjugasi.
Contoh:
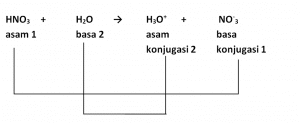
Pada reaksi di atas HNO3 adalah asam karena mendonorkan proton (H+) pada H2O. Sementara itu, H2O merupakan basa karena menerima proton (H+) dari HNO3. Oleh karena itu, H3O+ merupakan asam konjugasi dari H2O dan NO-3 merupakan basa konjugasi dari HNO3.
Teori Lewis
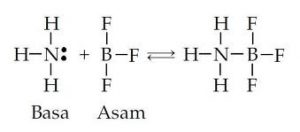
Pada tahun 1923, Gilbert N. Lewis, kimiawan dari Amerika Serikat mendefinisikan asam-basa berdasarkan teori ikatan kimia. Menurut Lewis, asam adalah penerima (akseptor) pasangan elektron bebas. Sementara itu, basa adalah pemberi (donor) pasangan elektron bebas.
Teori asam-basa Lewis lebih luas pengertiannya dibandingkan dengan dua teori sebelumnya. Spesi apa pun yang dapat menerima (akseptor) pasangan elektron bebas disebut asam Lewis. Contoh asam Lewis yaitu H+, B2H6, BF3, AIF3, Fe2+, Cu2+ ,dan Zn2+. Suatu spesi tidak selalu menyediakan orbital kosong untuk menjadi asam Lewis.
Spesi berupa molekul atau ion yang mendonorkan pasangan elektron bebasnya disebut basa Lewis. Contoh ion halida ( Cl-, F-, Br-, dan l-), NH3, OH-, H2O, senyawa yang mengandung unsur N, O, atau S, senyawa golongan eter, keton, dan C02.
Reaksi asam dan basa Lewis sebagai berikut:
Demikian penjelasan yang bisa kami sampaikan tentang Teori – Teori dan Konsep Asma Basa Menurut Para Ahli Dan Penjelasan. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- Contoh Soal Kimia Dan Pembahasan Terlengkap Tentang Reaksi Kesetimbangan
- Jenis Jenis Hubungan Kuantitatif Antara Pereaksi dan Hasil Reaksi
- Reaksi Kesetimbangan Kimia Dalam Industri Dan Kehidupan Sehari-hari
- Faktor Faktor yang Mempengaruhi Pergeseran Kesetimbangan
- Pengertian Reaksi Kimia, Kesetimbangan Kimia, dan Tetapan Kesetimbangan
- Berbagai Cara Penentuan Perubahan Entalpi Reaksi
- Penjelasan Kemolaran Dan Pengertian Laju Reaksi Serta Persamaannya