Pengertian, Rumus dan Contoh Soal Molaritas, Pembuatan Larutan dan Pengenceran Lengkap – Kali ini kita aka membahas tentang pengertian dan rumus molaritas, pembuatan larutan dan pengenceran beserta dengan contoh soal dan penyelesaiannya. Berikut penjelasan selengkapnya:
A. Molaritas
Konsentrasi ialah jumlah zat terlarut yang hadir terhadap jumlah pelarut tertentu atau terhadap jumlah larutan tertentu. (Dalam hal ini kita dapat mengasumsikan zat terlarut berwujud cair atau padat, sedangkan pelarutnya berwujud zat cair) Konsentrasi bisa diungkapkan dengan berbagai cara, salah satunya yang paling sering dipakai, dan memang akan kita gunakan sekarang ini yaitu Molaritas (M), atau konsentrasi molar. Molaritas ialah jumlah mol terlarut setiap liter larutan. Atau bisa diungkapkan dengan menggunakan rumus:
![]()
Atau bisa juga diungkapkan sebagai:
![]()
Dimana n menunjukan tentang jumlah mol zat terlarut (ingat ya zat terlarut) dan V menunjukan tentang volume larutan dalam liter (jangan lupa larutan dalam liter). Nah apabila yang diketahuinya bukan mol tapi melainkan gram zat terlarut, rumus tadi dapat juga diungkapkan dengan:
![]()
Satu lagi, apabila yang diketahui adalah massa jenis larutan (ρ) dan kadar atau persen massa (%), maka Molaritas bisa dicari dengan menggunakan rumus seperti:
Contoh:
1,46 molar larutan Glukosa (C6H12O6), ditulis dengan 1,46 M C6H12O6, yang artinya adalah mengandung 1,46 mol zat terlarut (C6H12O6) di dalam1 liter larutan (pelarut+terlarut). Tentu saja dalam hal ini volumenya tidak harus 1 liter, yang penting perbandingannya sama. Misalnya apabila volume larutan 500 mL (0,5L), maka C6H12O6 yang terlarut yaitu sebanyak 0,73 mol.
B. Pembuatan larutan
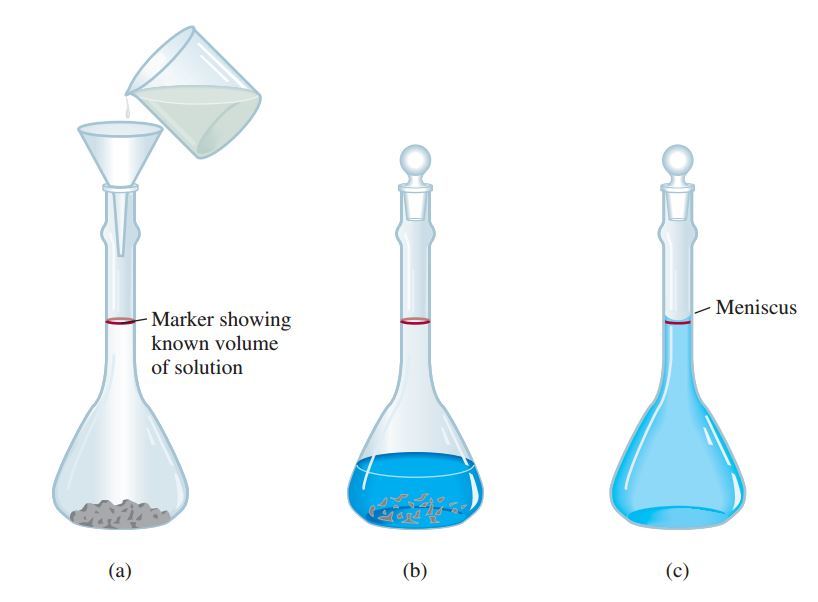
“masukan terlebih dahulu padatan, kemudian isi sedikit air. setelah larut baru tambahkan lagi air sampai batas garis”
Untuk membuat suatu larutan, yang tentunya nanti berhubungan langsung dengan molaritas. Langkah pertama yaitu memasukan zat terlarut yang sudah ditimbang terlebih dahulu (biasanya dalam bentuk padatan dengan massa dalam ukuran gram) ke dalam labu ukur melalui sebuah corong. Langkah selanjutnya adalah menambahkan sedikit air ke dalam labu ukur dengan perlahan hingga zat terlarut melarut sambil digoyang-goyangkan. Setelah zat terlarut tersebut sepenuhnya melarut, selanjutnya yaitu tambahkan sedikit demi sedikit air, dan jangan sampai melewati garis batas yang ada di labu ukur.
Dengan mengetahui suatu volume larutan yang dimasukkan ke dalam labu ukur, dan juga mengetahui jumlah dari zat terlarut (biasanya diukur dalam gram, sehingga nantinya biasa dirubah ke satu mol dengan rumus mol=gram/Mr) maka kita akan bisa menghitung Molaritas larutan tersebut.
C. Pengenceran
Seringkali larutan dibuat dan disimpan di dalam laboratorium dengan konsentrasi yang tinggi sebagai larutan ‘stok’. Hal ini akan lebih menghemat waktu daripada harus selalu membuat larutan setiap praktikum. Larutan ‘stok’ ini nantinya tinggal diambil sedikit, yang kemudian diencerkan sehingga konsentrasinya menjadi lebih kecil sesuai dengan kebutuhan. Oleh karena itu kita harus mengetahui cara mengencerkan larutan tersebut.
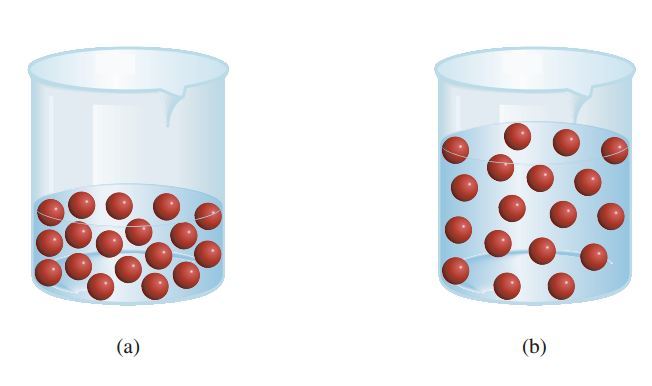
“(a) sebelum diencerkan, (b) seseudah diencerkan”
Ketika dilakukan sebuah pengenceran, sebenarnya jumlah mol zat terlarut tidaklah berubah, melainkan yang mengalami perubahan hanyalah volumenya saja. Mari kita lihat ilustrasinya
Jika terdapat 18 molekul terlarut sebelum diencerkan, maka ketika ditambahkan air, jumlah si molekul terlarut ini tidak akan berubah bukan? Ya tetap jumlahnya akan 18 molekul. Begitu juga dengan jumlah mol, tidak akan berubah. Sehingga, akan berlaku
nsebelum pengenceran = nsesudah pengenceran
dan berdasarkan rumus molaritas sebelumnya, dimana n =M.V, maka:
n1 = n2
M1 V1 = M2 V2
Dimana M1 adalah konsentrasi awal sebelum pengenceran dan M2 adalah kkonsentrasi larutan sesudah pengenceran.
Contoh soal
Berapakah Volume dari larutan H2SO4 2 M yang dibutuhkan untuk membuat larutan 200 mL H2SO4 0,5 M?
Jawab:
M1= 2 M, V1 = …?
M2 = 0,5 M, V2 = 200 mL
Maka:
M1 V1 = M2 V2
2 . V1 = 0,5 . 200
V1 = 50 mL
Demikian pembahasan tentang”Pengertian, Rumus dan Contoh Soal Molaritas, Pembuatan Larutan dan Pengenceran Lengkap” , semoga bermanfaat.
Originally posted 2023-05-10 04:53:09.





