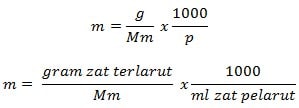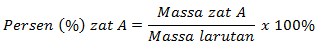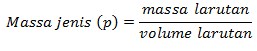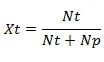Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap – Molalitas atau kosentrasi molal adalah ukuran konsentrasi dari suatu zat terlarut di dalam suatu larutan dalam hal jumlah zat dalam sejumlah massa tertentu dari pelarut. Hal tersebut berbeda dengan definisi molaritas yang berdasarkan pada volume tertentu larutan. Satuan umum molalitas dalam kimia yaitu mol/kg. Suatu larutan dengan konsentrasi 1 mol/kg juga terkadang dinyatakan sebagai 1 molal.
Istilah molalitas ini dibentuk dalam analogi terhadap molaritas yang merupakan konsentrasi molar dari suatu larutan. Molalitas suatu larutan bisa diuji dengan menambahkan beberapa zat pelarut. Lebih sederhananya, Molalitas (m) larutan adalah mol zat terlarut dibagi dengan kilogram pelarut. Kemolalan atau molalitas adalah konsentrasi larutan yang menyatakan jumlah mol (n) zat terlarut dalam 1 kg atau 1000 gram pelarut.
Perbedaan molalitas dan molaritas yaitu jika molalitas adalah kemolalan atau konsentrasi molal (m) menyatakan banyaknya mol zat terlarut dalam 1000 gram pelarut sedangkan molaritas adalah pernyataan jumlah mol zat terlarut dalam setiap satu liter larutan. Molaritas dilambangkan dengan notasi M dan satuannya adalah mol/liter.
Rumus Molalitas
Keterangan
m = molalitas (mol/kg)
g = gram zat terlarut (g)
Mm = massa molar zat (g/mol)
P = massa zat pelarut (g)
Hubungan Molalitas dengan Persen massa
Persen massa adalah satuan konsentrasi yang biasa digunakan dalam larutan kimia. Contohnya larutan yang bisa kita temukan sehari-hari yaitu larutan alkohol 75% dan larutan asam cuka 24%. Persen massa adalah jumlah gram zat terlarut dalam 100 gram massa larutan. Persamaan yang menunjukkan perhitungan persen massa adalah sebagai berikut :
Hubungan Molalitas dengan Molaritas
Molaritas menyatakan jumlah mol zat terlarut dalam satu liter larutan. Molaritas dapat dikonversikan menjadi molalitas dengan merubah volume larutan menjadi massa larutan. Pengubahan volume menjadi massa membutuhkan data massa jenis larutan (p), yang dapat dirumuskan sebagai berikut:
Fraksi Mol
Fraksi mol adalah suatu ukuran konsentrasi larutan yang menyatakan perbandingan dari jumlah mol pada sebagian zat terhadap jumlah keseluruhan mol yang ada dalam komponen larutan. Fraksi mol dibagi menjadi 2 bagian yaitu:
Fraksi mol zat terlarut (Xt)
Rumus fraksi mol zat terlarut (Xt), yaitu:
Keterangan:
Xt = fraksi mol zat terlarut
Nt = jumlah mol zat terlarut
Np = jumlah mol zat pelarut
Fraksi mol zat pelarut (Xp)
Rumus fraksi mol zat pelarut (Xp), yaitu:
Keterangan
Xp = fraksi mol zat pelarut
Nt = jumlah mol zat terlarut
Np = jumlah mol zat pelarut
Jumlah fraksi mol zat terlarut dan zat pelarut adalah 1
Xt + Xp = 1
Contoh Soal Molalitas dan Penyelesainya
1. Berapakah molalitas larutan yang mengandung 8 gram NaOH (Ar Na = 23 gr/mol, Ar O = 16 g/mol, dan Ar H = 1 gr/mol) terlarut dalam 250 gr air?
Pembahasan
Diketahui:
Massa NaOH = 8 gr
Ar Na = 23 gr/mol
Ar O = 16 g/mol
Ar H = 1 gr/mol
massa air = 250 gr = 0,25 kg
Ditanya: Molalitas (m)….?
Jawab:
Mr.NaOH = 40 gr/mol
Jumlah mol NaOH = massa/Mr
Jumlah mol NaOH = 8 gr/(40 gr/mol)
Jumlah mol NaOH = 0,2 mol
m = jumlah mol/p
m = 0,2 mol /0,25 kg
m = 0,8 m
2. Tentukan molalitas larutan yang dibuat dengan melarutkan 15 gram urea CO(NH2)2 dalam 250 gram air.
Pembahasan
Diketahui:
Massa urea = 15 gr
Mr Urea= 60 g/mol
Massa pelarut = 250 gr = 0,25 kg
Ditanya: Molalitas (m)…. ?
Jawab:
Jumlah mol Urea = massa/Mr
Jumlah mol Urea = 15 gr / 60 g/mol
Jumlah mol Urea = 0,25 mol
m = jumlah mol/ massa pelarut
m = 0,25 mol /0,25 kg
m = 1 m
3. Berapakah molalitas dari larutan HCl 37% (w/w)? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol).
Pembahasan
Diketahui:
massa HCl = 37%
Ar H = 1 g/mol
Ar Cl = 35,5 g/mol
Ditanya: Molalitas (m)…?
Jawab:
Mr.HCl = 36,5 gr/mol
Misalkan massa larutan adalah 100 gr maka massa HCl yaitu:
massa HCl = 37% x 100 gr
massa HCl = 37 gr
massa pelarut = massa larutan – massa HCl
massa pelarut = 100 gr – 37 gr
massa pelarut = 63 gr = 0,063 kg
jumlah mol HCl = massa/Mr
jumlah mol HCl = 37 gr /(36,5 gr/mol)
jumlah mol HCl = 1,01 mol
m = jumlah mol/ massa pelarut
m = 1,01 mol /0,063 kg
m = 16,03 m
4. Tentukan banyaknya (gram) NaOH yang harus dilarutkan dalam 1 liter air (air = 1,00 g/mL) agar diperoleh NaOH 0,25 m.
Pembahasan
Diketahui:
1 L air = 1.000 mL = 1.000 g (karena ρ air = 1,00 g/mL)
m NaOH = 0,25 m
Mr NaOh = 40
Ditanya: gr…?
Jawab:
m NaOH = gr / Mr x 1.000 / P
0,25 = gr/40 x 1.000/1.000
0,25 = g/40
g = 0,25 x 40
g = 10 gram
Jadi, banyaknya NaOH yang diperlukan adalah 10 gram.
5. Tentukan berapa mL volume air yang diperlukan untuk melarutkan 4,9 gram H2SO4 yang konsentrasinya 0,25 M (Ar H = 1; S = 32; O =16)!
Pembahasan
Diketahui:
m H2SO4 = 0,25
Mr H2SO4 = 98
gr = 4,9 gram
Ditanya: p..?
Jawab:
m = gr/Mr x 1.000/P
0,25 = 4,9/98 x 1.000/p
p = 20 gram (20 mL)
Jadi, volume air yaitu sebesar 20 mL.
Demikian pembahasan tentang “Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap” , semoga bermanfaat.
Originally posted 2023-07-09 10:03:22.