Telah kita pelajari tentang pengertan termokimia pada postingan sebelumnya. Bahwa Termokimia adalah cabang ilmu kimia yang mempelajari tentang perubahan kalor atau energi yang menyertai suatu reaksi kimia, baik yang diserap maupun yang dilepaskan. Untuk lebih lengkap nya Baca–> Termokimia
Dibawah ini admin sajikan beberapa contoh soal dan pembahasannya tentang materi termokimia.
Soal No.1
Diketahui 1 mol NO terurai menjadi unsur-unsur pembentuknya dengan melepaskan kalor sebesar 90,4 kJ.
a. Tuliskan persamaan termokimia dari reaksi tersebut!
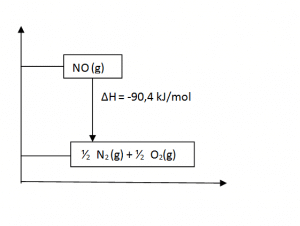
b. Gambarkan diagram tingkat energinya!
c. Tentukan perubahan entalpi untuk reaksi pembentukan 1,5 mol zat tersebut dan persamaan termokimianya!
Pembahasan:
a. Reaksi penguraian NO melepaskan kalor. Dengan demikian, perubahan entalpinya berharga negatif. Persamaan termokimia untuk 1 mol NO sebagai berikut.
NO(g) → ⅟2 N2(g) + ⅟2 O2(g) ∆H = -90,4 kJ/mol
b. Diagram tingkat energinya:
c. Perubahan entalpi pembentukan untuk 1,5 mol NO sebagai berikut.
Reaksi pengurai:
NO(g) → ⅟2 N2(g) + ⅟2 O2(g) ∆H = -90,4 kJ/mol
Reaksi pembentukan:
NO(g) → ⅟2 N2(g) + ⅟2 O2(g) ∆H = -90,4 kJ/mol
untuk 1,5 mol NO perubahan entalpinya sebesar 1,5 x 90,4 kJ = 135,6 kJ.
Jadi, persamaan termokimia untuk pem-bentukan 1,5 mol NO sebagai berikut.
N2(g) + O2(g) → 2NO(g) ∆H = + 135,6 kJ
Soal No.2
Kelompokkan reaksi-reaksi di bawah ini ke dalam reaksi endoterm atau reaksi eksoterm!
a. N204 (g) → 2N02(g) ∆H = +58 kJ
b. N2(g) + 3H2(g) → 2NH3(g) ∆H = -92 kJ
c. HCI(aq) + NaOH(aq) → NaCI(aq) + H20(ℓ) ∆H = -56 kJ
d. 2C(s) + H2(g) → C2H2(g) ∆H = +225 kJ
Pembahasan:
Reaksi:
- 2C(s) + H2(g) → C2H2(g) ∆H = +225kJ
- N204(g) → 2NO2(g) ∆H = +58 kJ
Termasuk reaksi endoterm karena memiliki ∆H positif. Sementara itu, reaksi:
- HCI(aq) + NaOH(aq) → NaCI(aq) + H20(ℓ) ∆H = -56 kJ
- N2(g) + 3H2(g) → 2NH3(g) ∆H = -92kJ
Termasuk reaksi eksoterm karena memiliki AH negatif.
Soal No.3
Diketahui entalpi pembentukan 14 g gas etilena (C2H4) adalah +26,15kJ.
a. Berapakah besarnya kalor yang dilepaskan untuk menguraikan 84 g gas etilena menjadi unsur-unsurnya?
b. Tuliskan persamaan termokimianya!
Pembahasan:
Perbandingan koefisien = perbandingan mol
Soal No.4
Diketahui persamaan termokimia reaksi pembakar- an gas asetilen (C2H2) sebagai berikut.
2C2H2(g) + 502(g) → 4C02(g) + 2H20(ℓ)
∆H = -2.599,1 kJ.
a. Tentukan entalpi pembakaran standar gas asetilen!
b. Hitung kalor yang dihasilkan pada pembakaran 10 L gas asetilen!
Pembahasan:
a. Entalpi pembakaran standar gas asetilen sebagai berikut.
Reaksi pembakaran pada persamaan reaksi 2C2H2 + 5O2 -+ 4CO2+ 2H2O menunjukkan bahwa pembakaran tersebut dilakukan untuk 2 mol gas C2H2, dengan membebaskan kalor sebesar 2.599,1 kJ. Oleh karena itu, entalpi pembakaran standar gas asetilen harus ditentukan untuk 1 mol gas asetilen. Dengan demikian, besarnya entalpi pembakaran standar gas asetilen adalah 2.599,1 kJ : 2 = 1.299,6 kJ.
b.Besarnya kalor yang dihasilkan pada pem-bakaran 10 L gas asetilen sebagai berikut. mol gas asetilen pada kondisi standar:
Soal No.5
Diketahui entalpi pembentukan standar (∆H°f) H20(ℓ) = -285,85 kJ/mol. Berapakah kalor yang diperlukan untuk menguraikan 13 gram air menjadi hidrogen dan oksigen pada keadaan standar? (Ar H = 1, Ar O = 16)
Pembahasan:
AH°f H20(ℓ) = -285,85 kJ/mol
Persamaan termokimia reaksi pembentukan H20:
H2(g) + ⅟2 O2(g) →H20(ℓ) ∆H = -285,85 kJ/mol.
Persamaan termokimia reaksi penguraian H20(ℓ)
H20(ℓ) →H2(g) + ⅟2 O2(g) ∆H =+285,85 kJ/mol.
Jumlah mol air dalam 10 gram air = 13 g /18g/mol – 0,72 mol.
Kalor yang diperlukan untuk menguraikan 13 g air = 0,72 mol/ 1 mol x 285,85 kJ/mol = 205,812 kJ/mol
Jadi, kalor yang diperlukan untuk menguraikan 13 gram air menjadi hidrogen dan oksigen sebesar 205,812 kJ.