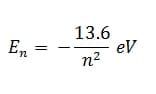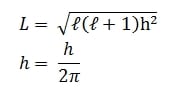Setelah kita bahas tentang perkembangan teori atom, disebutkan bahwa teori atom mengalami perkembangan yang pesat, dari hasil percobaan menunjukkan bahwa atom masih terdiri dari partikel – partikel yang lebih kecil yaitu proton, neutron dan elektron. kali ini kita bahas mengenai atom berelektron banyak.
Model atom Bohr dapat menjelaskan kestabilan atom dan spektrum garis atom hidrogen (deret Lyman, Balmer, Paschen, Bracket dan Pfund). Dalam penyelidikan selanjutnya, model atom Bohr tidak dapat menjelaskan:
- Efek Zeeman, yaitu gejala tambahan garis – garis spektrum jika atom – atom tereksitasi diletakkan dalam medan magnet.
- Spektrum dari atom – atom berelektron banyak.
Elektron – elektron yang bergerak dalam orbitnya mempertunjukkan sifat gelombang (teori de Broglie) sehingga orbit pasti elektron tidak dapat didefinisikan secara tepat melainkan hanya kebolehjadian menemukan elektron. Dengan demikian model atom Bohr digantikan dengan model atom baru, yakni disebut model atom mekanika kuantum. Setiap elektron dapat digolongkan berdasarkan empat bilangan kuantum yang akan diuraikan berikut ini.
Bilangan Kuantum Utama (n)
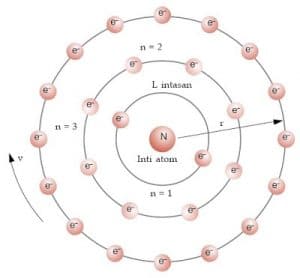
Bilangan kuantum utama (lambang n) sesuai dengan bilangan n yang digunakan oleh Bohr untuk menentukan energi total elektron. Energi total elektron bertanda negatif, yang berarti bahwa untuk mengeluarkan elektron sehingga bebas dari grbitnya diperlukan energi. Energi total elektron terkuantisasi artinya hanya dapat memiliki harga tertentu/diskret. Perhatikan, energi total elektron hanya bergantung pada n dan tidak pada bilangan-bilangan kuantum lainnya. Untuk atom hidrogen, energi total elektron dinyatakan oleh:
Nilai-nilai bilangan kuantum utama adalah bilangan bulat mulai dari 1 sampai tak hingga.
Bilangan kuantum utama (n) = 1,2, 3
Bilangan kuantum utama membatasi jumlah elektron yang dapat menempati suatu orbit
Jumlah elektron maksimum pada orbit ke – n = 2n2
Pada gejala efek Zeeman, Pieter Zeeman menemukan garis-garis tambahan dalam spektrum emisi jika atom-atom yang tereksitasi diletakkan dalam medan magnet. Efek Zeeman tidak dapat dijelaskan dengan orbit lingkaran Bohr karena orbit lingkaran Bohr hanya memiliki satu orientasi atom atau satu vektor momentum sudut.
Bilangan Kuantum Orbital (ℓ)
Berdasarkan efek Zeeman, Arnold Sommerfeld (1868-1951) mengusulkan orbit elips selain orbit lingkaran (orbit lingkaran adalah khusus dari orbit elips). Dengan orbit elips maka orientasi orbit dapat lebih dari satu, sehingga untuk menyatakan keadaan elektron diperlukan dua bilangan kuantum lain yang menyatakan vektor orbital (bilangan kuantum momentum sudut) dan bilangan kuantum magnetik. Bilangan kuantum orbital (diberi lambang ℓ) adalah bilangan kuantum yang menentukan besar momentum sudut elektron (L). Nilai l dibatasi oleh nilai n, yaitu bilangan bulat mulai dari 0 sampai (n-1)
Bilangan kuantum orbital (ℓ) = 0,1,2,3,…. ( n-1)
Misalnya untuk n = 3, nilai bilangan kuantum orbital yang diperbolehkan adalah ℓ= 0,1 dan 2. Hubungan antara ℓ dan besar momentum sudut L dinyatakan oleh:
h = tetapan Planck = 6,63 . 10-34 J.s
Bilangan Kuantum Magnetik (m)
Momentum sudut adalah suatu besaran vektor sehingga arahnyajuga harus ditentukan. Bilangan kuantum magnetik (diberi lambang mℓ), menunjukkan arah dari momentum sudut orbital L. Nilai mℓ adalah bilangan bulat mulai dari -1 sampai +1.
Bilangan kuantum magnetik (mℓ) = -ℓ1, …. 0, …+ ℓn
Misalnya untuk ℓ = 1, nilai bilangan kuantum magnetik yang diperbolehkan adalah mℓ= -1,0, dan +1.
Bilangan Kuantum Spin (s)
Bilangan kuantum spin (s) menentukan arah perputaran elektron pada porosnya, nilai s = + ½ dan – ½ .
Tabel dibawah ini merupakan tabel rangkuman keempat bilangan kuantum.
|
Nama |
Lambang |
Nilai yang diperbolehkan |
| Bilangan kuantum utama |
n |
1, 2, 3, … |
| Bilangan kuantum orbital |
ℓ |
0, 1, 2, 3… … (n-1) |
| Bilangan kuantum magnetic |
mℓ |
-ℓ, …, …, -2, -1, 0, +1, +2 , …,… +ℓ |
| Bilangan kuantum spin |
S |
– ½ , + ½ |
Demikian penjelasan yang bisa kami sampaikan tentang Atom Berelektron Banyak – Bilangan Kuantum Utama, Orbital, Magnetik dan Kuantum Spin. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- Perkembangan Teori Atom Menurut Ahli : Teori Thompson , Rutherford,Niels Bohr
- Pengertian Radiasi Benda Hitam,Rumus Soal Intensitas Radiasi, Teori Planck dan Radiasi Kalor
- Hukum Termodinamika I dan II,Penjelasan, Rumus dan Contoh Pembahasan Soal
- Ternodinamika – Rumus Usaha Dan Proses Proses Dalam Termodinamika Lengkap Pembahasan Soal
- Teori Kinetik Gas – Teorema Ekuipartisi Energi Dan Hubungan Antara Tekanan, Suhu Dan Energi Partikel Gas
- Teori Kinetik Gas – Persamaan Umum Gas, Hukum Gas Ideal Dan Pembahasan Contoh Soal