Istilah atom muncul sejak sebelum masehi yang pertama kali dikenalkan oleh Demokritus. Setiap zat terdiri dari bagian-bagian yang sangat kecil yang tidak dapat dibagi-bagi lagi, bagian yang sudah tidak dapat dibagi itulah yang disebut atom. Teori atom mengalami perkembangan yang pesat, dari hasil percobaan menunjukkan bahwa atom masih terdiri dari partikel- partikel yang lebih kecil yaitu proton, neutron dan elektron. Dan teori atom yang satu melengkapi dan memperbaiki teori atom yang lain. Hal ini dapat Anda temukan pada pokok bahasan berikut.
Perkembangan Teori Atom
Perkembangan Teori Atom Menurut Thompson (1904)

Menurut Thompson (1904), sebuah atom mempunyai muatan- muatan listrik positif yang tersebar merata di seluruh bagian atom. Muatan listrik ini dinetralkan oleh elektron-elektron yang tersebar di antara muatan-muatan listrik positif. Dalam gambarini, lingkaran-lingkaran putih adalah elektron dan lingkaran-lingkaran hitam adalah muatan listrik positif.
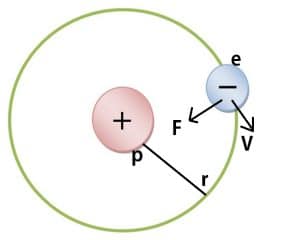
Ernest Rutherford (1871-1937) pada tahun 1911 melakukan percobaan untuk membuktikan kebenaran teori atom Thompson. Rutherford menemukan bahwa jenis muatan listrik positif (proton) dan muatan I strik negatif (elektron) tidak tersebar ke seluruh bagian atom. Menurut Rutherford, muatan listrik positif (proton) terkumpul pada pusat atom yang disebut inti atom. Elektron-elektron beredar mengelilingi inti atom. Jumlah proton yang terkumpul di dalam inti atom sama dengan jumlah elektron yang beredar mengelilingi inti.
Teori atom Rutherford mengandung beberapa kelemahan, dibawah ini adalah beberapa kelemaha dari Teori Atom Rutherford
- Elektron yang beredar mengelilingi inti atom akan memancarkan energi. Sehingga energi elektron itu akan semakin berkurang. Akibatnya, jari-jari orbit lintasan elektron akan semakin berkurang, sehingga pada suatu saat elektron akan bersatu dengan inti atom.
- Kelemahan kedua teori atom Rutherford adalah ketidakmampuannya menjelaskan terjadinya spektrum garis pada cahayayang dipancarkan oleh gas hidrogen. Seandainya benar elektron beredar dengan jari- jari lintasan yang makin kecil sampai bergabung dengan inti atom, lintasannya haruslah berbentuk spiral. Dengan demikian frekuensi gelombang elektromagnetik yang dipancarkan oleh atom hidroger akan berupa spektrum kontinu, mulai dari cahaya tampak sampai cahaya tidak tampak. Akan tetac hasil eksperimen menunjukan bahwa spektrum cahaya yang dipancarkan gas hidrogen adalah spektrum garis, bukan spektrum kontinu.
Perkembangan Teori Atom Menurut Niels Bohr (1885 – 1962)
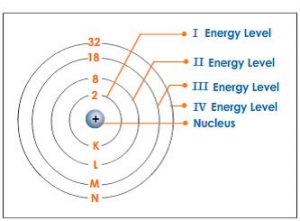
Pada tahun 1913 Niels Bohr (1885-1962) menyusun model atom hidrogen berdasarkan teori atorr Rutherford dan teori kuantum Planck. Teori atom Bohr bertolak dari dua postulat yaitu:
- Elektron tidak dapat beredar mengelilingi atom pada sembarang lintasan, tetapi hanya beredar melalui lintasan- lintasan tertentu. Pada lintasan tertentu itu elektron tidak memancarkan energi dan elektron mempunyai momentum sudut sebesar:
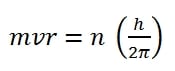
dengan n = 1.2.3.4 …. dan n disebut bilangan kuantum* utama. h adalah tetapan Planck, m massa elektron, v kecepatan tinier, dan r jari-jari elektron.
- Sebuah elektron akan memancarkan energi sebesar hf bila elektron itu berpindah dari lintasan tertentu dengan energi yang tinggi ke lintasan tertentu yang energinya rendah. Bila sebuah elektron berpindah dari lintasan tertentu yang energinya lebih rendah ke lintasan yang energinya tinggi, elektron itu menyerap energi sebesar hf.
Pada setiap lintasan, elektron mempunyai energi sebesar
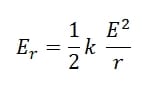
Kalau sebuah elektron jatuh dari sebuah lintasan yang energinya EA ke lintasan yang energinya Ea, maka energi elektron berkurang sebesar EA– EB Sesuai dengan hukum kekekalan energi, energi sebesar EA – EB berubah menjadi pancaran foton = h . f
Demikian penjelasan yang bisa kami sampaikan tentang Perkembangan Teori Atom Menurut Ahli : Teori Thompson , Rutherford,Niels Bohr. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- Pengertian Radiasi Benda Hitam,Rumus Soal Intensitas Radiasi, Teori Planck dan Radiasi Kalor
- Hukum Termodinamika I dan II,Penjelasan, Rumus dan Contoh Pembahasan Soal
- Ternodinamika – Rumus Usaha Dan Proses Proses Dalam Termodinamika Lengkap Pembahasan Soal
- Teori Kinetik Gas – Teorema Ekuipartisi Energi Dan Hubungan Antara Tekanan, Suhu Dan Energi Partikel Gas
- Teori Kinetik Gas – Persamaan Umum Gas, Hukum Gas Ideal Dan Pembahasan Contoh Soal
- Fluida Dinamis – Penjelasan Jenis Aliran Fluida Dinamis Dan Pembahasan Contoh Soal